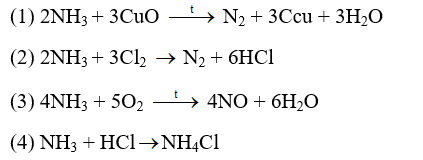Đề thi giữa kì 2 Hóa 10 - Kết nối tri thức - Đề số 7
Cho các phản ứng sau:
Đề bài
-
A.
1
-
B.
2
-
C.
3
-
D.
4
Phản ứng nào sau đây là phản ứng oxi hóa – khử?
-
A.
Fe3O4 + 4H2SO4 \( \to \) FeSO4 + Fe2(SO4)3 + 4H2O
-
B.
CuO + 2HCl \( \to \) CuCl2 + H2O
-
C.
3Mg + 4H2SO4 \( \to \) 3MgSO4 + S + 4H2O
-
D.
BaCl2 + H2SO4 \( \to \) BaSO4 + 2HCl
Cho phản ứng hóa học sau đây: . Phát biểu nào sau đây không đúng?
-
A.
O2 là chất oxi hóa
-
B.
Sự khử là: Co \( \to \) C+4 + 4e
-
C.
Sự khử là: \(\mathop O\nolimits_2^o + 4{\rm{e}} \to 2\mathop O\limits^{ - 2} \)
-
D.
C là chất khử
Fe2O3 là thành phần chính của quặng hematit đỏ, dùng để luyện gang. Số oxi hóa của iron trong Fe2O3 là:
-
A.
+3
-
B.
3+
-
C.
3
-
D.
-3
Cho phản ứng sau: Fe + HNO3 \( \to \) Fe(NO3)3 + NO + H2O. Tổng hệ số các chất sau khi cân bằng (với hệ số nguyên, tối giản) là
-
A.
16
-
B.
9
-
C.
10
-
D.
5
Cho phương trình hóa học sau: 3NO2 + H2O \( \to \) 2HNO3 + NO. Vai trò của NO2 trong phản ứng trên là gì
-
A.
Là chất khử
-
B.
Không là chất khử cũng không là chất oxi hóa
-
C.
Vừa là chất khử, vừa là chất oxi hóa
-
D.
Là chất oxi hóa
Trong phản ứng oxi hóa – khử, chất oxi hóa là chất khử
-
A.
nhường electron
-
B.
nhận electron
-
C.
nhận proton
-
D.
nhường proton
Cho 19,2 gam một kim loại M tan hoàn toàn trong dung dịch HNO3 loãng, dư thu được 4,958 lít khí NO (đkc, sản phẩm duy nhất). Kim loại M là
-
A.
Cu
-
B.
Zn
-
C.
Mg
-
D.
Fe
Cho 6,4 gam Cu tác dụng hoàn toàn với dung dịch HNO3 đặc sau phản ứng thu được V (lít) NO2 (đkc) là sản phẩm khử duy nhất của N+5. Tính giá trị của V.
-
A.
4,958 lít
-
B.
2,479 lít
-
C.
3,7185 lít
-
D.
1,2395 lít
Phát biểu nào sau đây sai?
-
A.
\({\Delta _r}H_{298}^0\)> 0 thì phản ứng thu nhiệt.
-
B.
\({\Delta _r}H_{298}^0\)< 0 thì phản ứng tỏa nhiệt
-
C.
Giá trị tuyệt đối của biến thiên enthalpy càng lớn thì nhiệt lượng tỏa ra hay thu vào của phản ứng càng ít
-
D.
Các phản ứng xảy ra ở nhiệt độ thường là phản ứng tỏa nhiệt, các phản ứng thu nhiệt thường xảy ra khi đun nóng.
Phát biểu nào sau đây không đúng?
-
A.
Các phản ứng phân hủy thường là phản ứng thu nhiệt
-
B.
Phản ứng càng tỏa ra nhiều nhiệt càng dễ tự xảy ra
-
C.
Phản ứng oix hóa chất béo cung cấp nhiệt cho cơ thể
-
D.
Các phản ứng khi đun nóng đều dễ xảy ra hơn.
Dựa vào phương trình nhiệt hóa học của các phản ứng sau:
CS2(l) + 3O2(g) \( \to \) CO2(g) + 2SO2(g) \({\Delta _r}H_{298}^0\)= -1110,21 kJ
CO2(g) \( \to \) CO(g) + ½ O2(g) \({\Delta _r}H_{298}^0\)= 280,00 kJ
Na(s) + 2H2O(l) \( \to \) NaOH(aq) + H2(g) \({\Delta _r}H_{298}^0\)= -367,50 kJ
ZnSO4(s) \( \to \) ZnO(s) + SO3(g) \({\Delta _r}H_{298}^0\)= 235,21 kJ
Cặp phản ứng thu nhiệt là
-
A.
(1) và (2)
-
B.
(3) và (4)
-
C.
(1) và (3)
-
D.
(2) và (4)
Đơn vị của nhiệt tạo thành chuẩn là
-
A.
kJ
-
B.
kJ/mol
-
C.
mol/kJ
-
D.
J
Cho phản ứng: 2ZnS(s) + 3O2 \( \to \) 2ZnO(s) + 2SO2(g) \({\Delta _r}H_{298}^0\)=-285,66 kJ
Giá trị của \({\Delta _r}H_{298}^0\)khi lấy gấp 3 lần khối lượng của các chất là
-
A.
-856,98 kJ
-
B.
-865,98 kJ
-
C.
-856,89 kJ
-
D.
-865,89 kJ
Cho các phản ứng dưới đây:
(1) CO(g) + ½ O2(g) \( \to \) CO2(g) \({\Delta _r}H_{298}^0\)=-283 kJ
(2) C(s) + H2O(g)\( \to \) CO(g) + H2(g) \({\Delta _r}H_{298}^0\)=131,25kJ
(3) H2(g) + F2(g) \( \to \) 2HF(g) \({\Delta _r}H_{298}^0\)=-546kJ
(4) H2(g) + Cl2(g) \( \to \) 2HCl(g) \({\Delta _r}H_{298}^0\)=-184,62 kJ
Phản ứng xảy ra thuận lợi nhất là
-
A.
phản ứng (1)
-
B.
phản ứng (2)
-
C.
phản ứng (3)
-
D.
phản ứng (4)
Phương trình nhiệt hóa học giữa nitrogen và oxygen như sau: \( \to \)\({\Delta _r}H_{298}^0\)
N2(g) + O2(g) 2NO(g) =180 kJ
Kết luận nào sau đây đúng?
-
A.
nitrogen và oxygen phản ứng mạnh hơn khi ở nhiệt độ thấp
-
B.
phản ứng tỏa nhiệt
-
C.
phản ứng xảy ra thuận lợi hơn ở điều kiện thường
-
D.
phản ứng hóa học xảy ra có sự hấp thụ nhiệt năng từ môi trường
Cho phương trình nhiệt hóa học sau:
NaOH(aq) + HCl(aq) \( \to \) NaCl(aq) + H2O(l) \({\Delta _r}H_{298}^0\)= -57,3 kJ
Lượng nhiệt tỏa ra khi dùng dung dịch có chứa 8 gam NaOH trung hòa lượng vừa đủ dung dịch HCl là
-
A.
-14,16 kJ
-
B.
-1,146 kJ
-
C.
-11,46 kJ
-
D.
-114,6 kJ
-
A.
-890,2 (kJ/mol).
-
B.
-882,4 (kJ/mol).
-
C.
-790,8 (kJ/mol).
-
D.
-875,6 (kJ/mol)
Cho biến thiên enthalpy của phản ứng sau ở điều kiện chuẩn:
C2H4(g) + H2(g) \( \to \)C2H6(g)
Biết năng lượng liên kết của một số liên kết được cho dưới bảng sau

Cho các mệnh đều sau:
a) \({\Delta _r}H_{298}^o = - 134kJ\)
b) \(\sum {{E_b}(c{\rm{d}}) = 2720} kJ\)
c) \(\sum {{E_b}(sp) = 3254} kJ\)
d) Đây là phản ứng thu nhiệt.
Số mệnh đề đúng là
-
A.
3
-
B.
4
-
C.
2
-
D.
1
Cho phản ứng hóa học xảy ra ở điều kiện chuẩn sau:
2NO2 (đỏ nâu) \( \to \) N2O4 (không màu)
Biết NO2 và N2O4 có \({\Delta _f}H_{298}^o\)tương ứng là 33,18 kJ/mol và 9,16kJ/mol. Điều này chứng tỏ phản ứng
-
A.
tỏa nhiệt, NO2 bền vững hơn N2O4
-
B.
thu nhiệt, NO2 bền vững hơn N2O4
-
C.
tỏa nhiệt, N2O4 bền vững hơn NO2
-
D.
thu nhiệt, N2O4 bền vững hơn NO2
Lời giải và đáp án
-
A.
1
-
B.
2
-
C.
3
-
D.
4
Đáp án : C
Chất khử là chất nhường electron (số oxi hóa tăng)
Chất khử là chất nhường electron (số oxi hóa tăng)
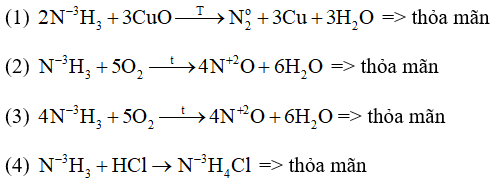
Các phản ứng NH3 thể hiện tính khử là: (1), (2), (3)
Đáp án C
Phản ứng nào sau đây là phản ứng oxi hóa – khử?
-
A.
Fe3O4 + 4H2SO4 \( \to \) FeSO4 + Fe2(SO4)3 + 4H2O
-
B.
CuO + 2HCl \( \to \) CuCl2 + H2O
-
C.
3Mg + 4H2SO4 \( \to \) 3MgSO4 + S + 4H2O
-
D.
BaCl2 + H2SO4 \( \to \) BaSO4 + 2HCl
Đáp án : C
Phản ứng oxi hóa – khử là phản ứng hóa học trong đó có sự thay đổi số oxi hóa
Phản ứng oxi hóa – khử là:
\(3M{g^o} + 4{H_2}\mathop S\limits^{ + 6} {O_4} \to 3MgS{O_4} + {S^o} + 4{H_2}{\rm{O}}\)
Đáp án C
Cho phản ứng hóa học sau đây: . Phát biểu nào sau đây không đúng?
-
A.
O2 là chất oxi hóa
-
B.
Sự khử là: Co \( \to \) C+4 + 4e
-
C.
Sự khử là: \(\mathop O\nolimits_2^o + 4{\rm{e}} \to 2\mathop O\limits^{ - 2} \)
-
D.
C là chất khử
Đáp án : B
Khái niệm chất khử, chất oxi hóa, sự khử, sự oxi hóa:
- Chất khử (bị oxi hóa) là chất cho electron ⟹ số oxi hóa tăng.
- Chất oxi hóa (bị khử) là chất nhận eletron ⟹ số oxi hóa giảm.
- Sự khử (quá trình khử) là quá trình nhận electron. - Sự oxi hóa (quá trình oxi hóa) là quá trình cho electron.
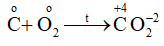
Sự oxi hóa: Co \( \to \) C+4 + 4e => C là chất khử
Sự khử: \(\mathop O\nolimits_2^o + 4{\rm{e}} \to 2\mathop O\limits^{ - 2} \)=> O2 là chất oxi hóa
Đáp án B
Fe2O3 là thành phần chính của quặng hematit đỏ, dùng để luyện gang. Số oxi hóa của iron trong Fe2O3 là:
-
A.
+3
-
B.
3+
-
C.
3
-
D.
-3
Đáp án : A
Dựa vào cách xác định số oxi hóa
Gọi số oxi hóa của Fe trong Fe2O3 là x
2.x + 3.(-2) = 0
=> x = +3
Đáp án A
Cho phản ứng sau: Fe + HNO3 \( \to \) Fe(NO3)3 + NO + H2O. Tổng hệ số các chất sau khi cân bằng (với hệ số nguyên, tối giản) là
-
A.
16
-
B.
9
-
C.
10
-
D.
5
Đáp án : B
Cân bằng phản ứng oxi hóa – khử bằng phương pháp thăng bằng electron:
1. Xác định số oxi hóa của những nguyên tố có số oxi hóa thay đổi.
2. Viết quá trình oxi hóa và quá trình khử, cân bằng mỗi quá trình.
3. Tìm hệ số thích hợp sao cho tổng số electron do chất khử nhường bằng tổng số electron do chất oxi hóa nhận.
4. Đặt hệ số của chất oxi hóa và chất khử vào sơ đồ phản ứng. Hoàn thành phương trình hóa học.
Các quá trình nhường, nhận electron
\(F{e^o} \to F{e^{ + 3}} + 3{\rm{e}}|x1\)
\({N^{ + 5}} + 3{\rm{e}} \to {N^{ + 2}}|x1\)
Thêm hệ số vào phản ứng ta có: Fe + 4HNO3 \( \to \) Fe(NO3)3 + NO + 2H2O
=> Tổng hệ số các chất là: 1 + 4 + 1 + 1 + 2 = 9
Đáp án B
Cho phương trình hóa học sau: 3NO2 + H2O \( \to \) 2HNO3 + NO. Vai trò của NO2 trong phản ứng trên là gì
-
A.
Là chất khử
-
B.
Không là chất khử cũng không là chất oxi hóa
-
C.
Vừa là chất khử, vừa là chất oxi hóa
-
D.
Là chất oxi hóa
Đáp án : C
Viết các quá trình nhường, nhận electron để xác định vai trò của NO2 (N+4).
- Chất khử (bị oxi hóa) là chất cho electron ⟹ số oxi hóa tăng.
- Chất oxi hóa (bị khử) là chất nhận eletron ⟹ số oxi hóa giảm.
\(3\mathop N\limits^{ + 4} {O_2} + {H_2}{\rm{O}} \to 2H\mathop N\limits^{ + 5} {O_3} + \mathop N\limits^{ + 2} O\)
Quá trình nhường electron: N+4\( \to \)N+5 + 1e
Quá trình nhận electron: N+4 + 2e\( \to \)N+2
Ta thấy, N+4 vừa tham gia vào quá trình nhường electron (là chất khử), vừa tham gia vào quá trình nhận electron (là chất oxi hóa)
Vậy NO2 vừa là chất khử, vừa là chất oxi hóa
Đáp án C
Trong phản ứng oxi hóa – khử, chất oxi hóa là chất khử
-
A.
nhường electron
-
B.
nhận electron
-
C.
nhận proton
-
D.
nhường proton
Đáp án : B
Dựa vào lý thuyết về phản ứng oxi hóa – khử
Trong phản ứng oxi hóa – khử, chất oxi hóa là chất nhận electron
Đáp án B
Cho 19,2 gam một kim loại M tan hoàn toàn trong dung dịch HNO3 loãng, dư thu được 4,958 lít khí NO (đkc, sản phẩm duy nhất). Kim loại M là
-
A.
Cu
-
B.
Zn
-
C.
Mg
-
D.
Fe
Đáp án : A
Các quá trình nhường nhận electron
M \( \to \) Mn+ + ne
N+5 + 3e\( \to \) N+2
Áp dụng bảo toàn electron => mối quan hệ giữa M và n
Biện luận với n = 1,2,3 để chọn ra M thỏa mãn => tên kim loại
n NO = 0,2 mol
Các quá trình nhường nhận e:
M – ne \( \to \) Mn+
N+5 + 3e \( \to \) N+2
Bảo toàn electron: n.n M = 3.n NO => \(\frac{{19,2}}{M}.n = 3.0,2 \Rightarrow M = 32n\)
Biện luận với n = 1;2;3 thấy với n = 2; M = 64 (Cu) thỏa mãn
Đáp án A
Cho 6,4 gam Cu tác dụng hoàn toàn với dung dịch HNO3 đặc sau phản ứng thu được V (lít) NO2 (đkc) là sản phẩm khử duy nhất của N+5. Tính giá trị của V.
-
A.
4,958 lít
-
B.
2,479 lít
-
C.
3,7185 lít
-
D.
1,2395 lít
Đáp án : A
Cuo \( \to \) Cu+2 + 2e
N+5 + 1e\( \to \) N+4
Bảo toàn electron: 2.nCu = n NO2
Đáp án A
Phát biểu nào sau đây sai?
-
A.
\({\Delta _r}H_{298}^0\)> 0 thì phản ứng thu nhiệt.
-
B.
\({\Delta _r}H_{298}^0\)< 0 thì phản ứng tỏa nhiệt
-
C.
Giá trị tuyệt đối của biến thiên enthalpy càng lớn thì nhiệt lượng tỏa ra hay thu vào của phản ứng càng ít
-
D.
Các phản ứng xảy ra ở nhiệt độ thường là phản ứng tỏa nhiệt, các phản ứng thu nhiệt thường xảy ra khi đun nóng.
Đáp án : C
C sai, vì giá trị tuyệt đối của biến thiên enthalpy càng lớn thì nhiệt lượng tỏa ra hay thu vào của phản ứng càng nhiều
Đáp án C
Phát biểu nào sau đây không đúng?
-
A.
Các phản ứng phân hủy thường là phản ứng thu nhiệt
-
B.
Phản ứng càng tỏa ra nhiều nhiệt càng dễ tự xảy ra
-
C.
Phản ứng oix hóa chất béo cung cấp nhiệt cho cơ thể
-
D.
Các phản ứng khi đun nóng đều dễ xảy ra hơn.
Đáp án : D
Các phản ứng tỏa nhiệt như: CO2 + CaO \( \to \) CaCO3, phản ứng lên men… khó xảy ra khi đun nóng => D sai
Đáp án D
Dựa vào phương trình nhiệt hóa học của các phản ứng sau:
CS2(l) + 3O2(g) \( \to \) CO2(g) + 2SO2(g) \({\Delta _r}H_{298}^0\)= -1110,21 kJ
CO2(g) \( \to \) CO(g) + ½ O2(g) \({\Delta _r}H_{298}^0\)= 280,00 kJ
Na(s) + 2H2O(l) \( \to \) NaOH(aq) + H2(g) \({\Delta _r}H_{298}^0\)= -367,50 kJ
ZnSO4(s) \( \to \) ZnO(s) + SO3(g) \({\Delta _r}H_{298}^0\)= 235,21 kJ
Cặp phản ứng thu nhiệt là
-
A.
(1) và (2)
-
B.
(3) và (4)
-
C.
(1) và (3)
-
D.
(2) và (4)
Đáp án : D
\({\Delta _r}H_{298}^0\)> 0 => phản ứng thu nhiệt
\({\Delta _r}H_{298}^0\)< 0 => phản ứng tỏa nhiệt
Cặp phản ứng thu nhiệt là (2) và (4).
Đáp án D
Đơn vị của nhiệt tạo thành chuẩn là
-
A.
kJ
-
B.
kJ/mol
-
C.
mol/kJ
-
D.
J
Đáp án : B
Dựa vào lý thuyết về năng lượng hóa học
Đơn vị của nhiệt tạo thành chuẩn là kJ/mol
Đáp án B
Cho phản ứng: 2ZnS(s) + 3O2 \( \to \) 2ZnO(s) + 2SO2(g) \({\Delta _r}H_{298}^0\)=-285,66 kJ
Giá trị của \({\Delta _r}H_{298}^0\)khi lấy gấp 3 lần khối lượng của các chất là
-
A.
-856,98 kJ
-
B.
-865,98 kJ
-
C.
-856,89 kJ
-
D.
-865,89 kJ
Đáp án : A
Dựa vào lý thuyết về enthalpy
Giá trị của \({\Delta _r}H_{298}^0\)khi lấy gấp 3 lần khối lượng của các chất là \({\Delta _r}H_{298}^0\)= -285,66.3 = -856,98 kJ
Đáp án A
Cho các phản ứng dưới đây:
(1) CO(g) + ½ O2(g) \( \to \) CO2(g) \({\Delta _r}H_{298}^0\)=-283 kJ
(2) C(s) + H2O(g)\( \to \) CO(g) + H2(g) \({\Delta _r}H_{298}^0\)=131,25kJ
(3) H2(g) + F2(g) \( \to \) 2HF(g) \({\Delta _r}H_{298}^0\)=-546kJ
(4) H2(g) + Cl2(g) \( \to \) 2HCl(g) \({\Delta _r}H_{298}^0\)=-184,62 kJ
Phản ứng xảy ra thuận lợi nhất là
-
A.
phản ứng (1)
-
B.
phản ứng (2)
-
C.
phản ứng (3)
-
D.
phản ứng (4)
Đáp án : C
Dựa vào lý thuyết về năng lượng hóa học
Phản ứng xảy ra thuận lợi nhất là phản ứng (3)
Đáp án C
Phương trình nhiệt hóa học giữa nitrogen và oxygen như sau: \( \to \)\({\Delta _r}H_{298}^0\)
N2(g) + O2(g) 2NO(g) =180 kJ
Kết luận nào sau đây đúng?
-
A.
nitrogen và oxygen phản ứng mạnh hơn khi ở nhiệt độ thấp
-
B.
phản ứng tỏa nhiệt
-
C.
phản ứng xảy ra thuận lợi hơn ở điều kiện thường
-
D.
phản ứng hóa học xảy ra có sự hấp thụ nhiệt năng từ môi trường
Đáp án : D
Dựa vào lý thuyết về năng lượng hóa học
A sai, vì nitrogen và oxygen phản ứng mạnh hơn khi ở nhiệt độ cao
B sai, vì phản ứng thu nhiệt
C sai, vì phản ứng xảy ra thuận lợi hơn ở nhiệt độ cao
D đúng
Đáp án D
Cho phương trình nhiệt hóa học sau:
NaOH(aq) + HCl(aq) \( \to \) NaCl(aq) + H2O(l) \({\Delta _r}H_{298}^0\)= -57,3 kJ
Lượng nhiệt tỏa ra khi dùng dung dịch có chứa 8 gam NaOH trung hòa lượng vừa đủ dung dịch HCl là
-
A.
-14,16 kJ
-
B.
-1,146 kJ
-
C.
-11,46 kJ
-
D.
-114,6 kJ
Đáp án : C
Dựa vào lý thuyết về biến thiên enthalpy của phản ứng hóa học
n NaOH = 8:40 = 0,2 mol
=> Lượng nhiệt tỏa ra khi cho 8gam NaOH phản ứng vừa đủ với HCl là: (-57,3).0,2 = -11,46 kJ
Đáp án C
-
A.
-890,2 (kJ/mol).
-
B.
-882,4 (kJ/mol).
-
C.
-790,8 (kJ/mol).
-
D.
-875,6 (kJ/mol)
Đáp án : A
Dựa vào lý thuyết về năng lượng hóa học.
\(\begin{array}{l}{\Delta _r}H_{298}^o = {\Delta _f}H_{298}^o(C{O_2},g) + 2.{\Delta _f}H_{298}^o({H_2}{\rm{O}},g) - {\Delta _f}H_{298}^o(C{H_4},g) - 0\\ \to {\Delta _r}H_{298}^o = - 393,5 + 2.( - 285,8) - ( - 74,9) = - 890,2kJ/mol\end{array}\)
Đáp án A
Cho biến thiên enthalpy của phản ứng sau ở điều kiện chuẩn:
C2H4(g) + H2(g) \( \to \)C2H6(g)
Biết năng lượng liên kết của một số liên kết được cho dưới bảng sau

Cho các mệnh đều sau:
a) \({\Delta _r}H_{298}^o = - 134kJ\)
b) \(\sum {{E_b}(c{\rm{d}}) = 2720} kJ\)
c) \(\sum {{E_b}(sp) = 3254} kJ\)
d) Đây là phản ứng thu nhiệt.
Số mệnh đề đúng là
-
A.
3
-
B.
4
-
C.
2
-
D.
1
Đáp án : C
Dựa vào lý thuyết về năng lượng hóa học
a), b) đúng
c), d) sai
\({\Delta _r}H_{298}^o = \sum {{E_b}(c{\rm{d}}) - \sum {{E_b}(sp) = (4{E_{C - H}} + {E_{C = C}} + {E_{H - H}}) - (6{{\rm{E}}_{C - H}} + {E_{C - C}}) = 2720 - 2854 = - 134kJ/mol} } \)
=> phản ứng tỏa nhiệt
Đáp án C
Cho phản ứng hóa học xảy ra ở điều kiện chuẩn sau:
2NO2 (đỏ nâu) \( \to \) N2O4 (không màu)
Biết NO2 và N2O4 có \({\Delta _f}H_{298}^o\)tương ứng là 33,18 kJ/mol và 9,16kJ/mol. Điều này chứng tỏ phản ứng
-
A.
tỏa nhiệt, NO2 bền vững hơn N2O4
-
B.
thu nhiệt, NO2 bền vững hơn N2O4
-
C.
tỏa nhiệt, N2O4 bền vững hơn NO2
-
D.
thu nhiệt, N2O4 bền vững hơn NO2
Đáp án : C
Lý thuyết về enthalpy
Phản ứng tỏa nhiệt, N2O4 bền vững hơn NO2
Đáp án C
Số oxi hóa của các nguyên tử trong đơn chất bằng
Số oxi hóa của nitrogen trong hợp chất KNO3 là
Phát biểu nào sau đây là đúng?
Cho các phản ứng hóa học sau:
Có phản ứng hoá học xảy ra như sau: H2S + 4Cl2 + 4H2O H2SO4
Khi cho Cu vào dung dịch FeCl3; H2S
Số oxi hóa của S trong hợp chất H2SO3 là: